TAVI(経カテーテル大動脈弁治療)の
特徴と臨床成績
大動脈弁狭窄症に対するTAVIは様々な有用性が認められています
TAVI(経カテーテル大動脈弁治療)の
特徴と臨床成績
大動脈弁狭窄症に対するTAVIは様々な有用性が認められています
TAVIとは
- Transcatheter Aortic Valve Implantationの略です(経カテーテル大動脈弁治療)。
- 重症ASに対する治療法で、開胸することなく、また心臓を止めることなく、カテーテルを使用して患者さんの心臓に人工弁を留置します。
- 低侵襲に加えて、人工心肺を使用しなくて済むことから、患者さんの体への負担が少なく、入院期間も短いことが特徴です。
- TAVIには健康保険が適用されます。また1か月に支払った医療費が上限額を超えた場合、その超えた金額を支給する「高額療養費制度」も利用することができます。
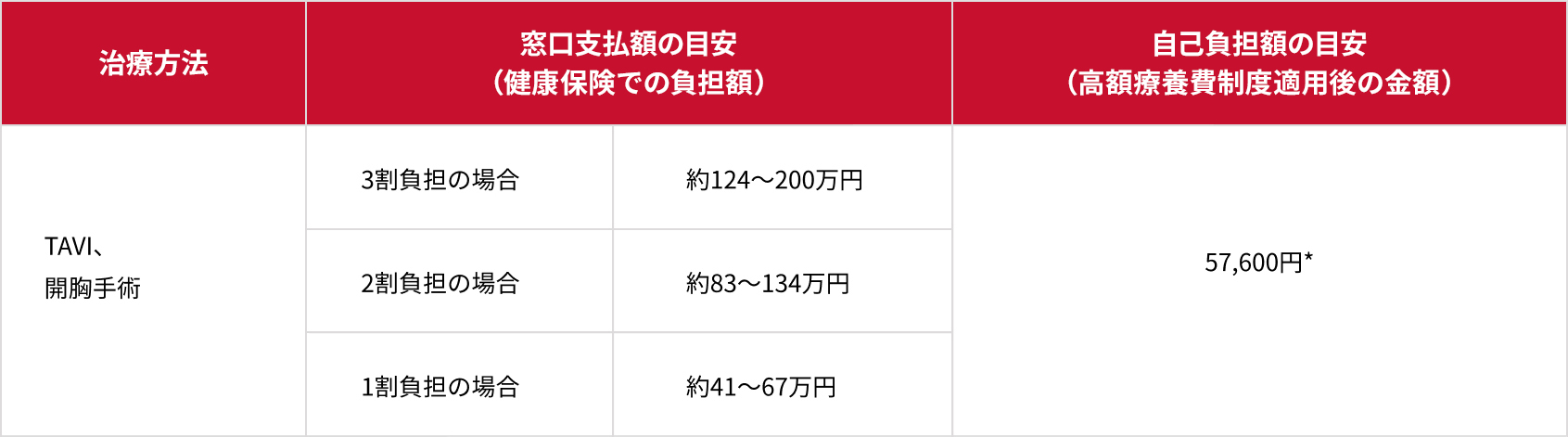
*住民税非課税世帯を除く年収約370万円未満の場合。年収約370万円以上の場合の自己負担額は異なります。
※また、上記はあくまでも、目安であり、患者さんごとに行われる治療や施設などにより異なります。
厚生労働省/高額療養費制度を利用される皆さまへ
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/iryouhoken/juuyou/kougakuiryou/index.html(2023年11月閲覧)
Kamon T, et al.: Circ Rep. 2020; 2(12): 753-758.
TAVIに期待されるポイント

TAVIのアプローチ法
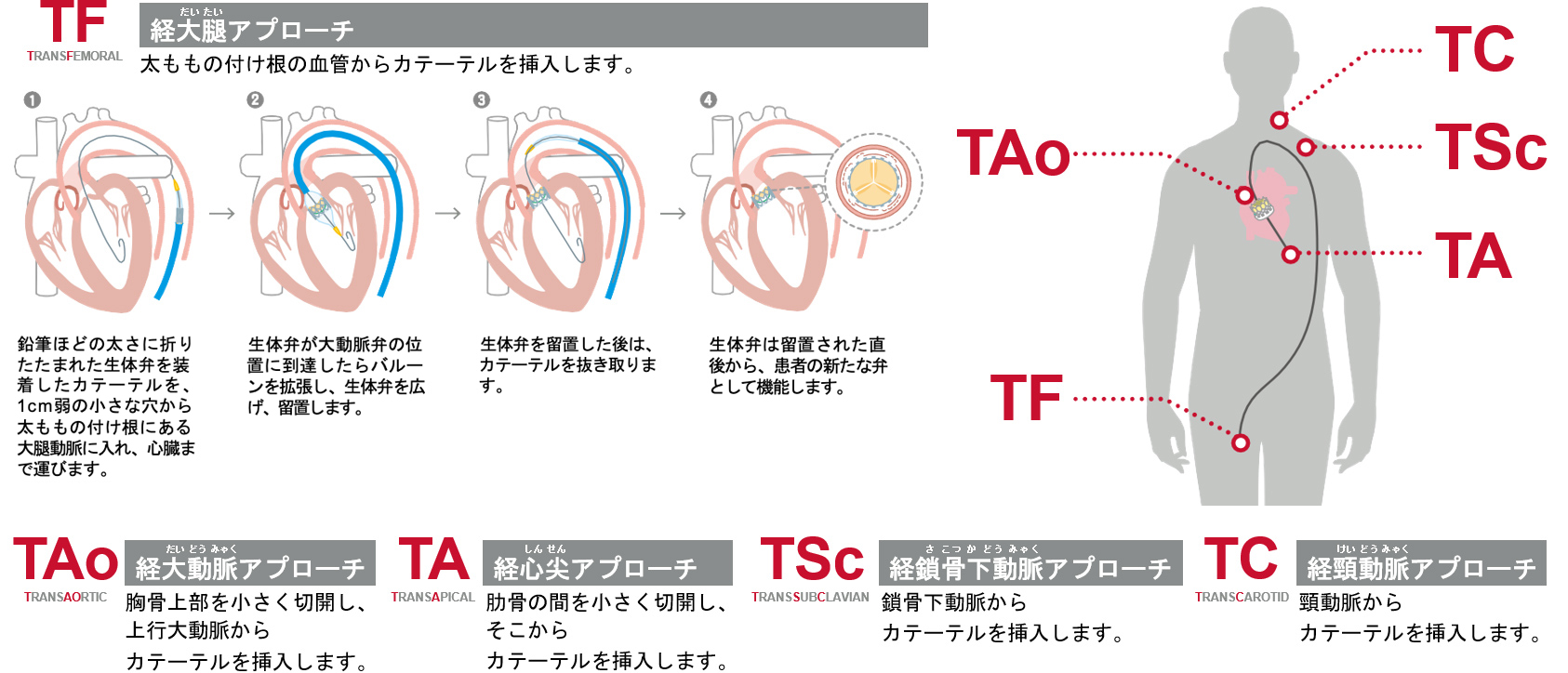
TAVIには、4通りのアプローチ方法があります。太ももの付け根の血管から挿入する「経大腿アプローチ」、肋骨の間を小さく切開し、心臓の先端(心尖部)から挿入する「経心尖アプローチ」、胸骨上部を小さく切開し、上行大動脈から挿入する「経大動脈アプローチ」、 鎖骨下動脈から挿入する「経鎖骨下動脈アプローチ」があります。
患者さんの状態に最適な方法を弁膜症チームの医師が選択します。いずれのアプローチにおいても少ない身体的負担で治療が可能です。
*ASに対する治療方針は個々の患者さんの容態または施設によって異なります。
TAVIのアプローチ法
TFアプローチ動画を見る
TAVIの適応
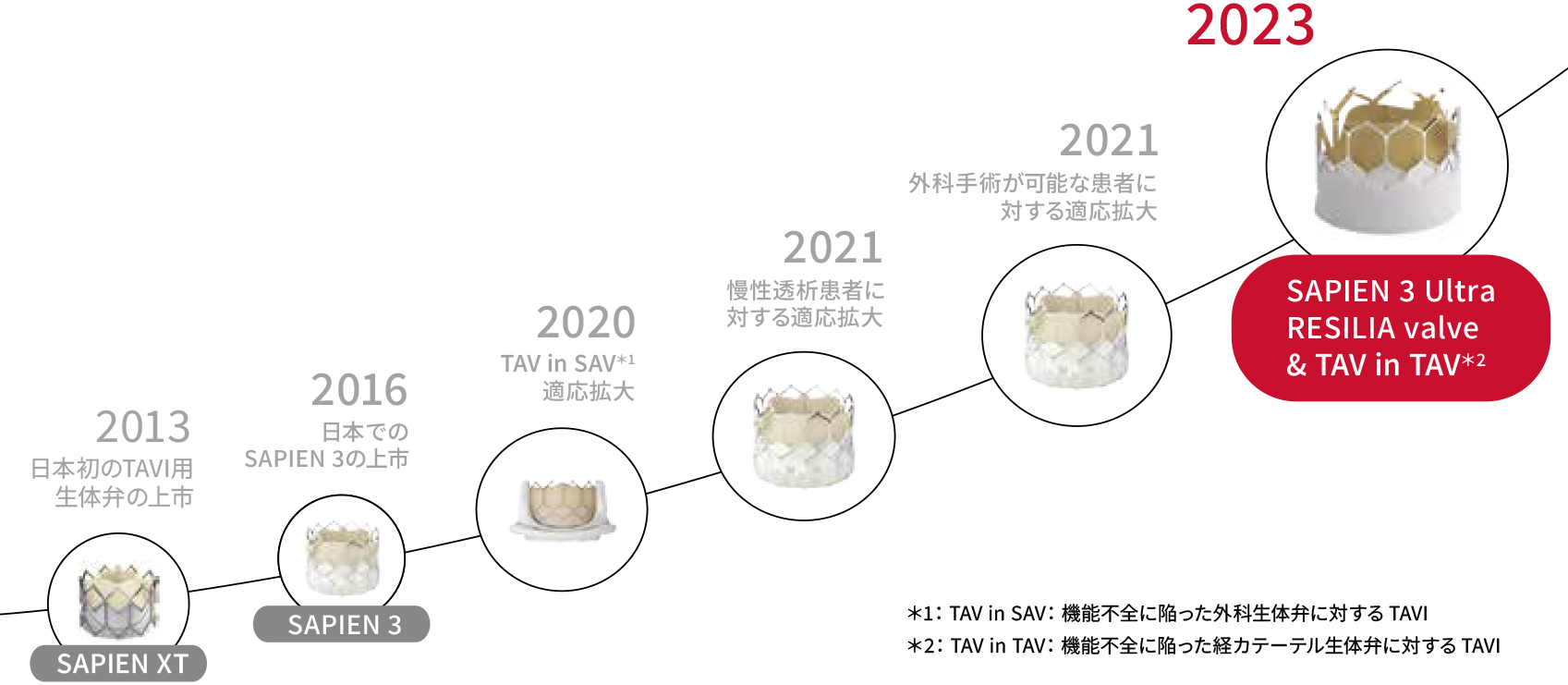
2013年の保険適用以降、エビデンスの蓄積に伴いTAVIを検討可能な患者像が広がっています。 2020年には、機能不全による再置換が必要となった外科生体弁に対してTAVIを実施する「TAV in SAV」が承認され、2021年には慢性透析患者に対する適応拡大、2023年には改良された新たなデバイスSAPIEN 3 Ultra RESILIA Valveが上市され、TAVI弁の機能不全の際に、開胸せずに新たなTAVI弁を追加で留置する治療法「TAV in TAV」も保険適用になりました。
TAVIの臨床成績
TAVIの臨床成績については、様々な国や地域において大規模な臨床研究がなされており、有効性、安全性、生活の質などにおいて、長期的にも良好な結果が得られています。
また、発売からデバイスの改良がおこなわれています。
TAVIを用いた臨床試験:PARTNER Trial

PARTNER 3試験1
試験概要
外科手術低リスクの重症AS患者において、TAVIのSAVRに対する非劣性を検証するために行われた臨床試験です。日本の3施設を含む、米国、カナダ、オーストラリア、ニュージーランドの計71施設において、TAVIまたはSAVRを施行された患者1,000例が対象とされました。
試験デザイン
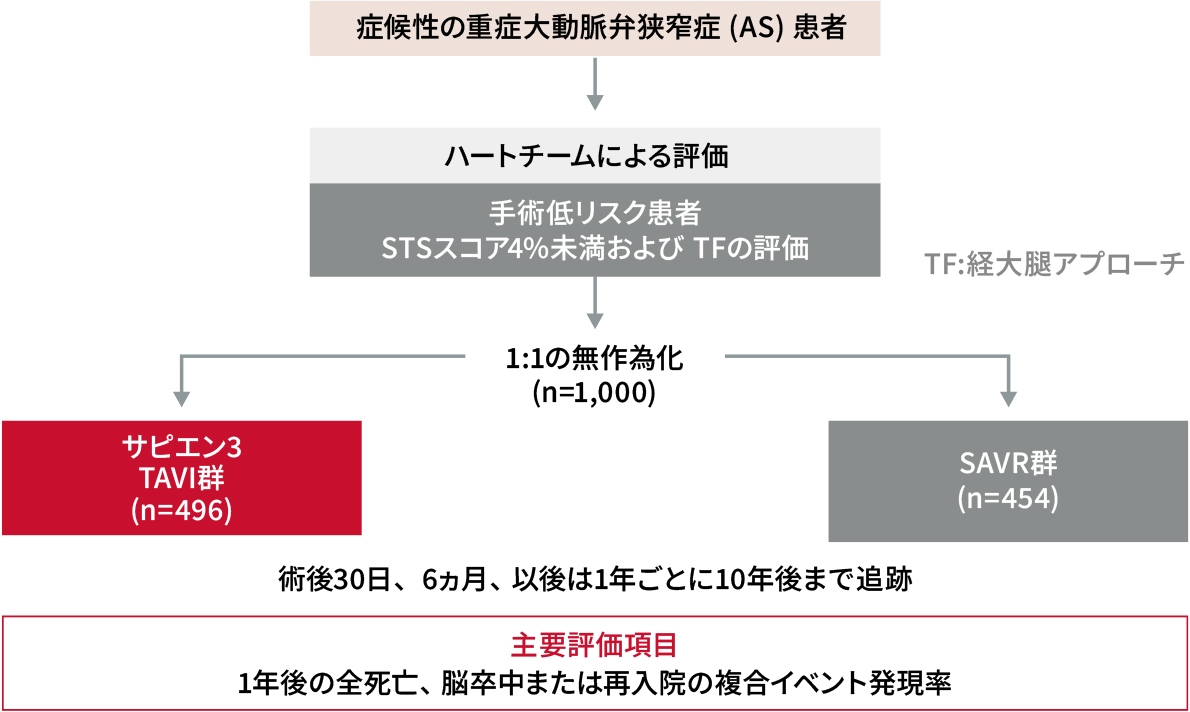
Mack MJ, et al: N Engl J Med380 (18): 1695-1705,2019
患者背景
外科手術高リスク患者を対象としたPARTNER1A、中等度リスク患者を対象としたPARTNER2Aと比較し、PARTNER3試験では年齢が若く、冠動脈疾患(CAD)の合併および術前ペースメーカ留置率が少なく、QOLの高い患者が登録されました。
PARTNER試験 患者背景
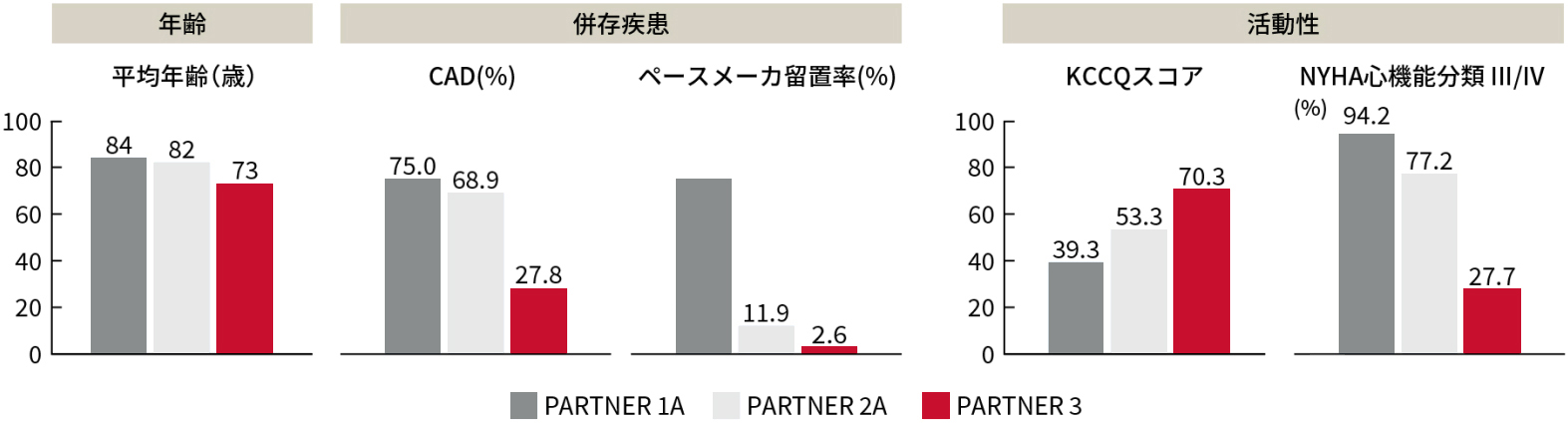
Smith CR, et al. N Engl J Med. 2011;364:2187-98., Leon MB, et al, N Engl J Med. 2016;374:1609-20.,
Mack MJ, et al. N Engl J Med. 2019;380:1695-1705より作成9
結果
1年次主要評価項目(全死亡、脳卒中または再入院の発現率)
1年後の全死亡、脳卒中または再入院*の複合イベントの発生率は、TAVI群で8.5%であったのに対しSAVR群では15.1%であり、SAVRに対するTAVIの優越性が示されました(優越性P=0.0016、Z検定)。
*治験弁または手技に関連した入院、及び心不全による入院
主要評価項目(全死亡、脳卒中または再入院の発現率)
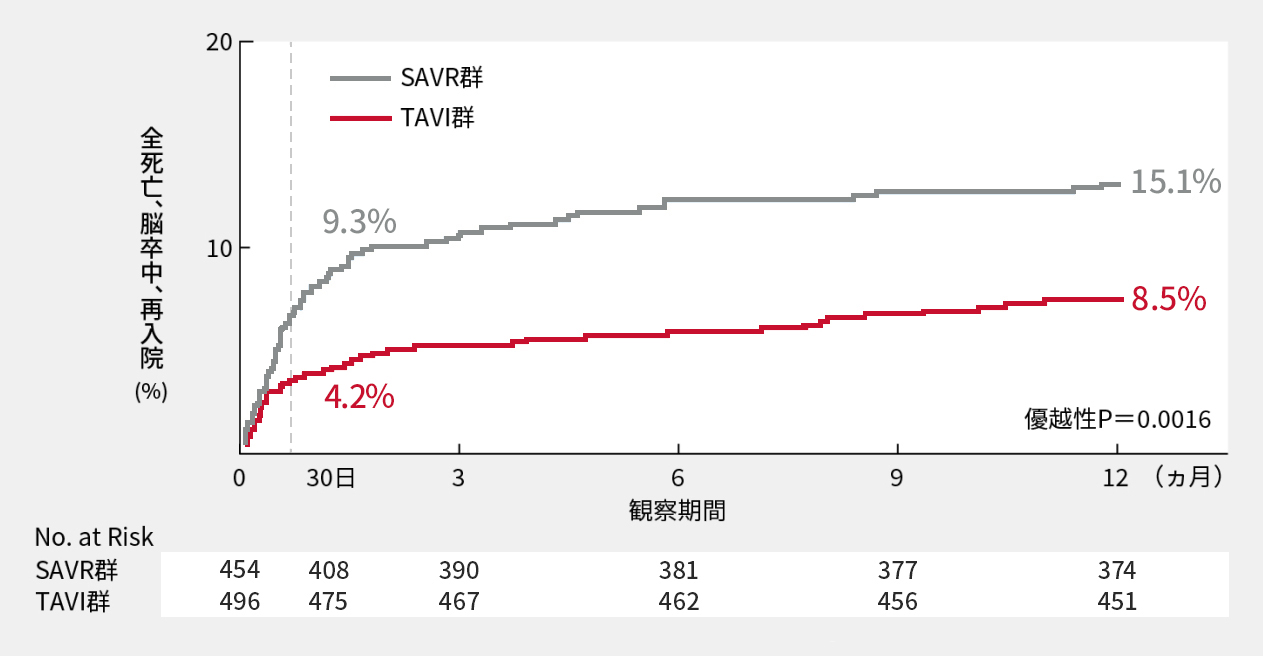
*非劣性検定:両群の差(TAVI群-SAVR群)の両側95%信頼区間上限値は-2.52%であり,非劣性マージン6.0%を下回ったことから,TAVI群のSAVR群に対する非劣性が示された。
エドワーズライフサイエンス合同会社 承認時評価資料
5年次主要評価項目(全死亡、脳卒中または再入院の発現率)3
5年後の全死亡、脳卒中または再入院の複合イベントの発生率はTAVI群で22.8%、SAVR群で27.2%でした。
主要評価項目(全死亡、脳卒中または再入院の発現率)
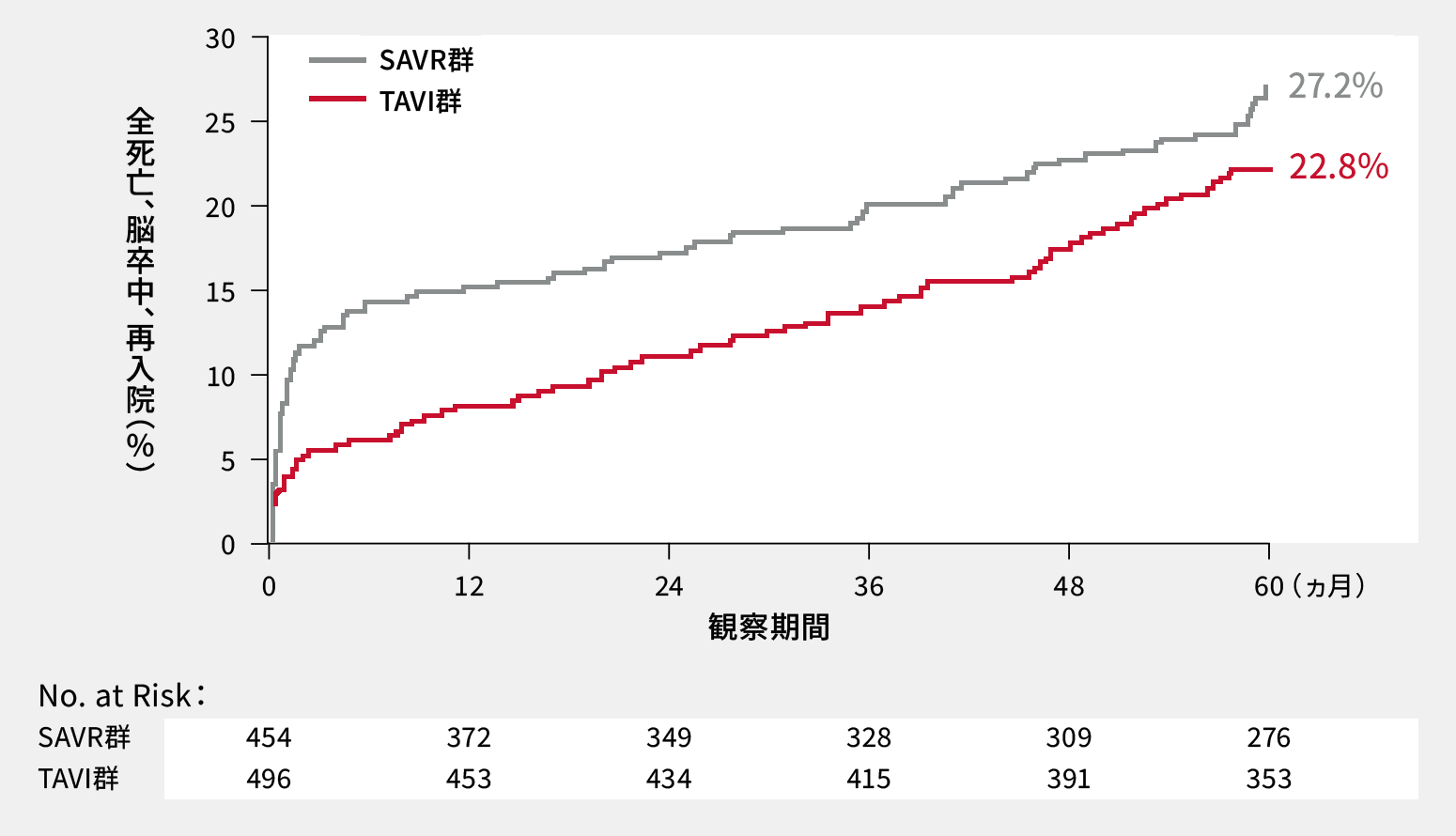
検定方法:5年時の各群におけるイベント発現率はKaplan-Meier法で推定した。全死亡、脳卒中または再入院のイベント発現率についてはWald検定を用いてTAVIのSAVRに対する優越性を評価した(群間差-4.3%、p=0.07)
Mack MJ,et al.: N Engl J Med. 2023 Oct 24. doi: 10.1056/NEJMoa2307447. Online ahead of print.
安全性評価項目
TAVI群では術後30日における障害を伴う脳卒中が0%でした。心房細動の新規発症、生命を脅かす出血はSAVRと比較して少ない結果でした。中等度以上の弁周囲逆流、新規ペースメーカ留置率においてはSAVRと同等でした。*
安全性評価項目
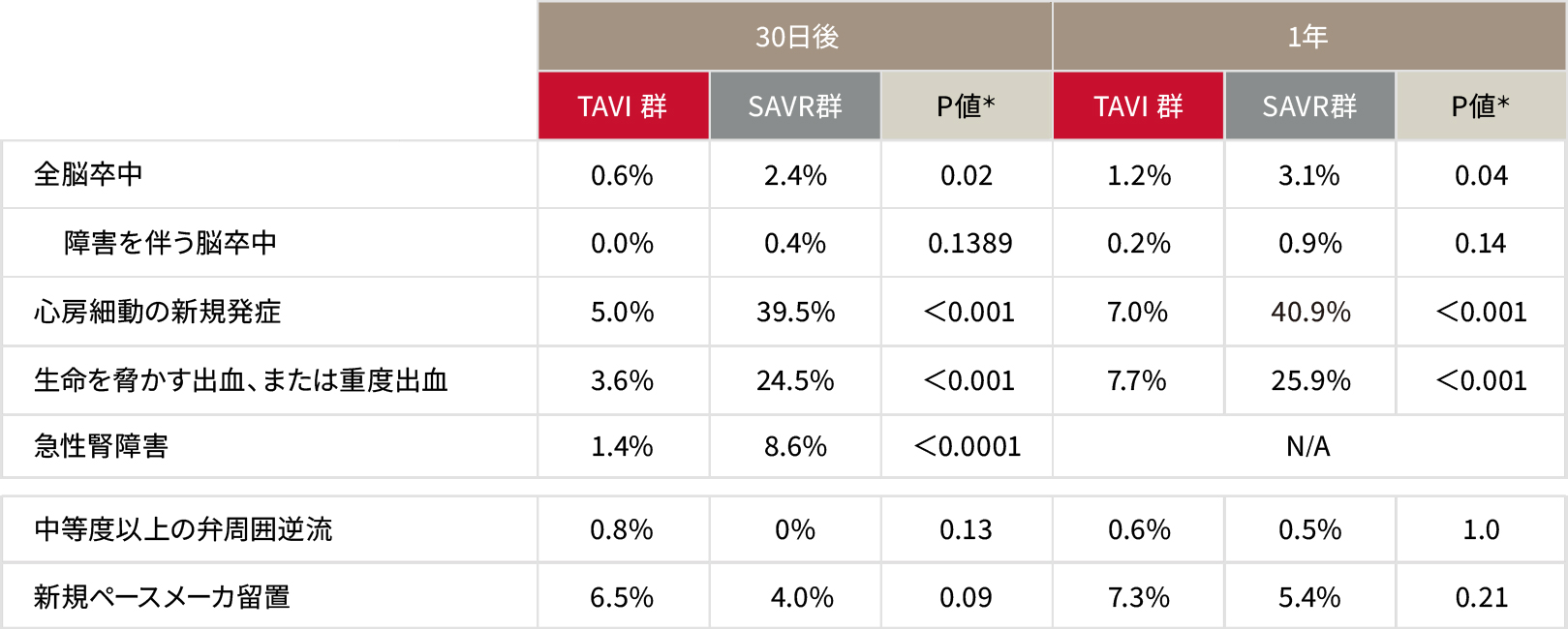
*Log-rank検定(急性腎障害のみFisherの正確性検定)
エドワーズライフサイエンス合同会社 承認時評価資料
有効性に関する評価項目
6分間歩行試験およびKCCQスコアにおいて、TAVI群は30日後にSAVR群に比べて改善傾向を示し、1年後も同程度の改善を維持していました。
有効性に関する評価項目
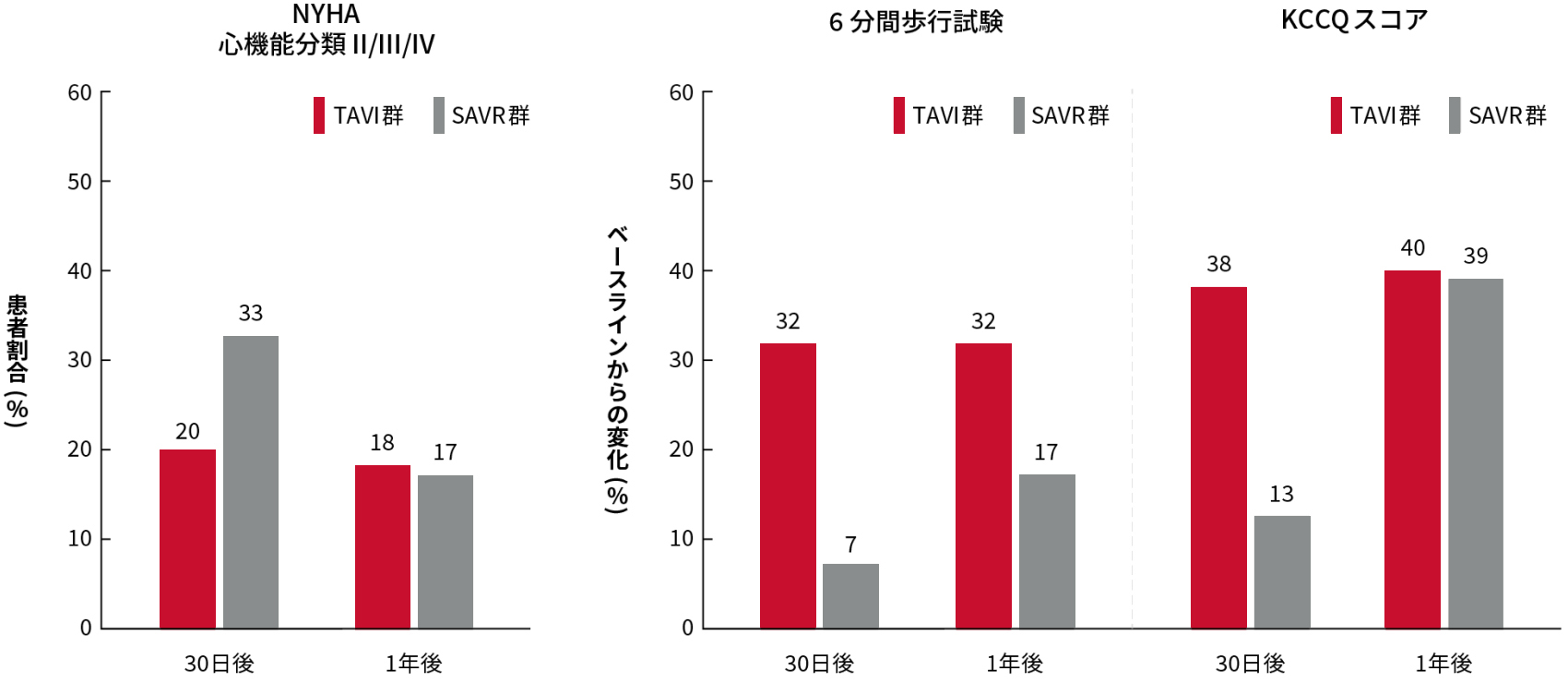
エドワーズライフサイエンス合同会社 承認時評価資料.
Mack MJ, et al. N Engl J Med. 2019;380:1695-1705.
国内におけるReal Worldデータ(OCEAN-TAVI registry)4
試験概要
2013年10月から2016年7月までにTAVIを施行され、14施設からなるOCEAN-TAVI registryに登録された1,613例を対象に日本でのReal WorldにおけるTAVI1年後の全死亡率、TF群/非TF群別の死亡率などを検討した臨床成績です。
結果
全死亡率は、30日で1.7%、1年後で11.3%でした。また、心血管死亡率は、30日で1.4%、1年後で4.5%でした。TF群の死亡率は、30日後で1.6%、1年後については9.2%であり、非TF群に比べて有意に低値でした。
全死亡率(Kaplan-Meier法)・TF群/非TF群の合計
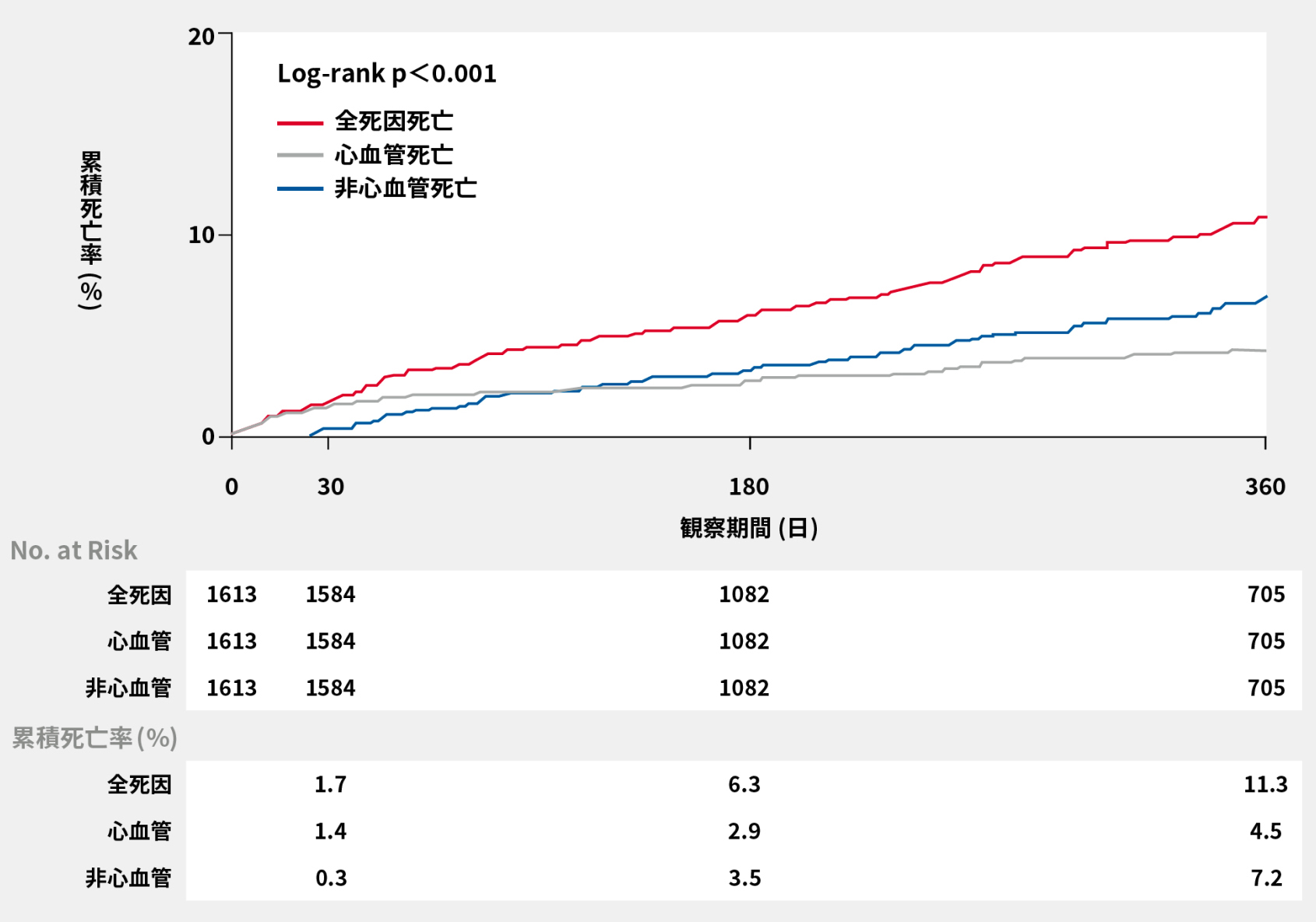
Yamamoto M, et al. Cardiovasc Revasc Med 2018. pii: S1553-8389 30569-4.
OCEAN-TAVI registryはエドワーズライフサイエンス合同会社から資金提供を受けている
TAVI後の合併症の発現率
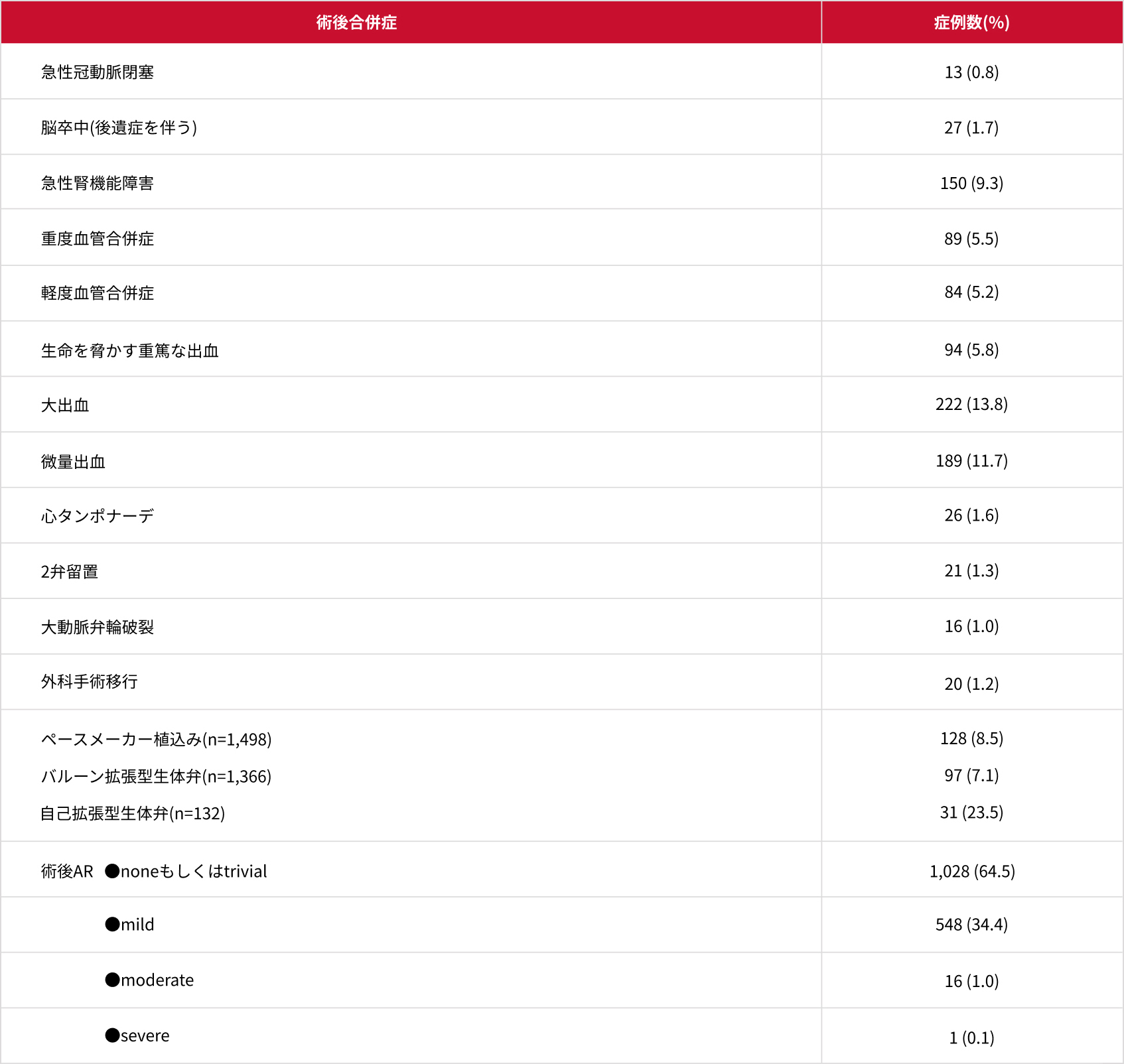
AR:大動脈弁閉鎖不全症
Yamamoto M, et al. Cardiovasc Revasc Med 2018. pii: S1553-8389 30569-4.
OCEAN-TAVI registryはエドワーズライフサイエンス合同会社から資金提供を受けている
TAVI弁の耐久性
5〜10年データ
UK TAVIレジストリ研究では、91%の患者はTAVI施行後5~10年後にTAVI弁の構造的弁劣化(SVD)を認めませんでした5。
SVD非発生率:Kaplan-Meier曲線
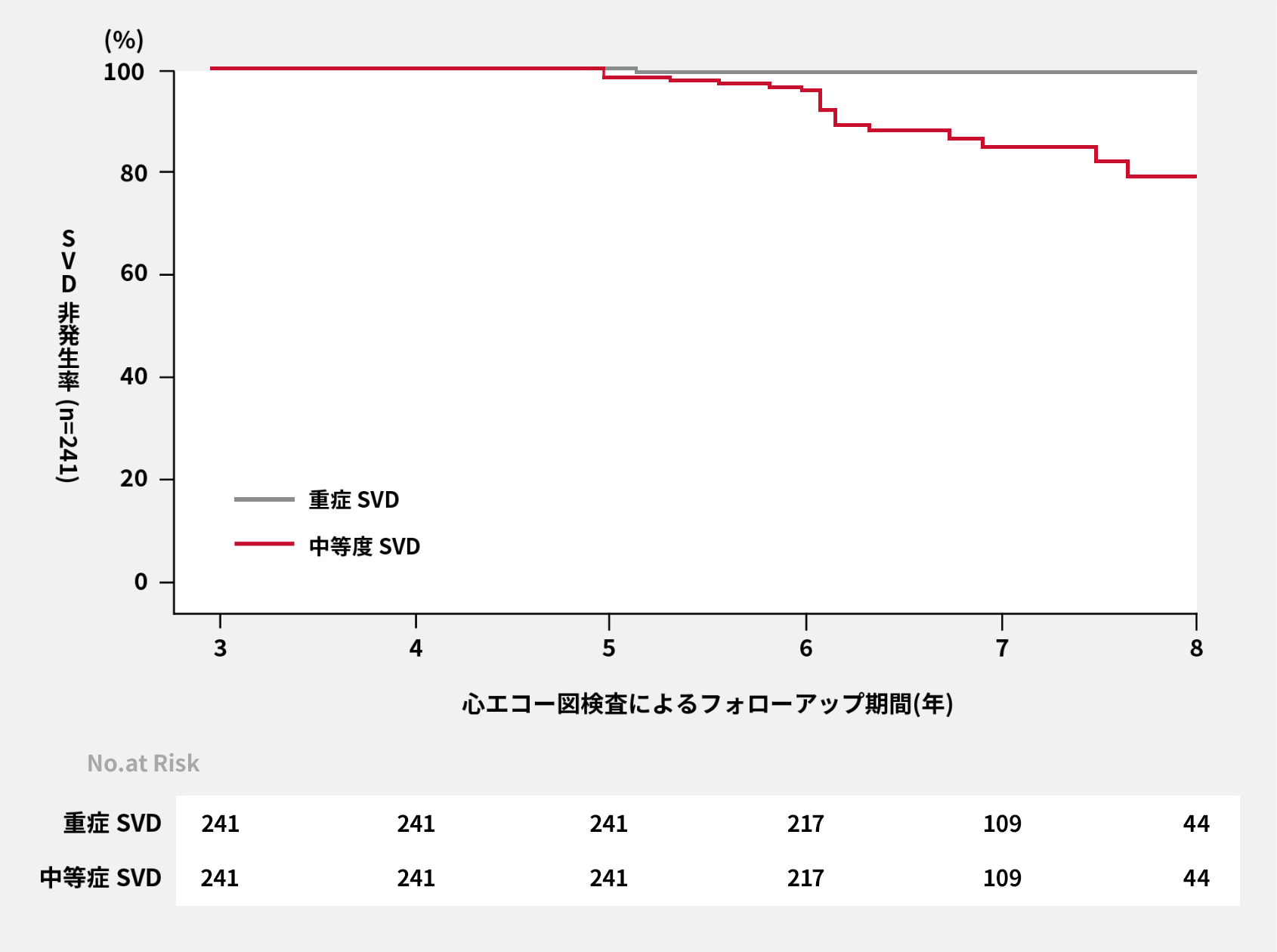
Blackman DJ, et al. J Am Coll Cardiol 2019;73:537-45.
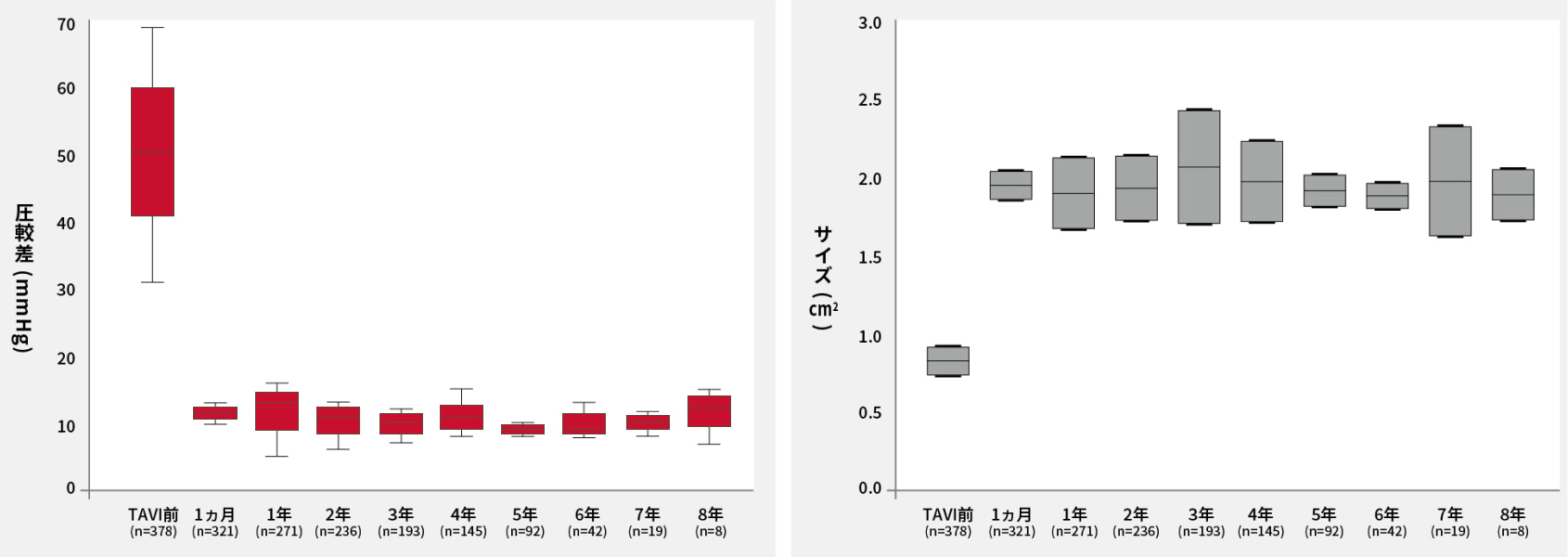
2017年に発表された耐久性基準に基づき、TAVI弁のSVDを評価した試験では、追跡期間8年後に平均圧較差ならびに有効弁口面積とも変化はありませんでした6。
大動脈弁平均圧較差(mmHg)(A)と有効弁口面積(cm2)(B)のボックスプロット
10年データ7
目的
経カテーテル大動脈弁置換術(TAVI)を施行した大動脈弁狭窄症(AS)患者の追跡期間10年間における人工弁構造的弁劣化(SVD)/生体弁機能不全(BVF)発生率を評価すること。
対象
2005~2009年にASのため、または外科的大動脈弁置換術が不成功に終わり、本レジストリーに連続して登録されたTAVI施行患者235例
方法
SVDは欧州経皮的冠動脈インターベンション学会の人工弁の構造的劣化および機能不全の標準的定義に関するコンセンサスステートメントに従い、定義した。血行動態上の中等度SVDを平均圧較差20~<40mmHg、ベースラインからの平均圧較差の変化量10~<20mmHg、または中等度の人工弁逆流の新規発生あるいはベースラインに比べた悪化と定義し、血行動態上の重度SVDを平均圧較差≥40mmHg、ベースラインからの平均圧較差の変化量≥20mmHg、または重度の人工弁逆流の新規発生あるいはベースラインに比べた悪化と定義した。BVFは大動脈弁置換術後の再介入および血行動態上の重度SVDと定義した。
評価項目:TAVI施行10年後のSVD/BVF発生率、QOLなど
結果
TAVI施行時の平均年齢は82.4 ± 7.9歳で、全例で手術リスクが高いと判定された。10年間の累積SVD/BVF発生率は6.5%であり(図)、10年後に生存していた患者は19例であった。日常生活動作(ADL: Katz index [入浴、更衣、トイレの使用、移動、排尿・排便、食事の6領域]にて評価)および介助なしの歩行で測定したQOLに関しては、43.8%がADLの6/6(6/6:自立度が高い、0/6:自立度が非常に低い)であり、62.5%で介助なしの歩行が可能であった。また、10年の観察期間中、再介入を必要とした重度SVDの患者は2例のみであった。
10年間の累積SVD/BVF発生率
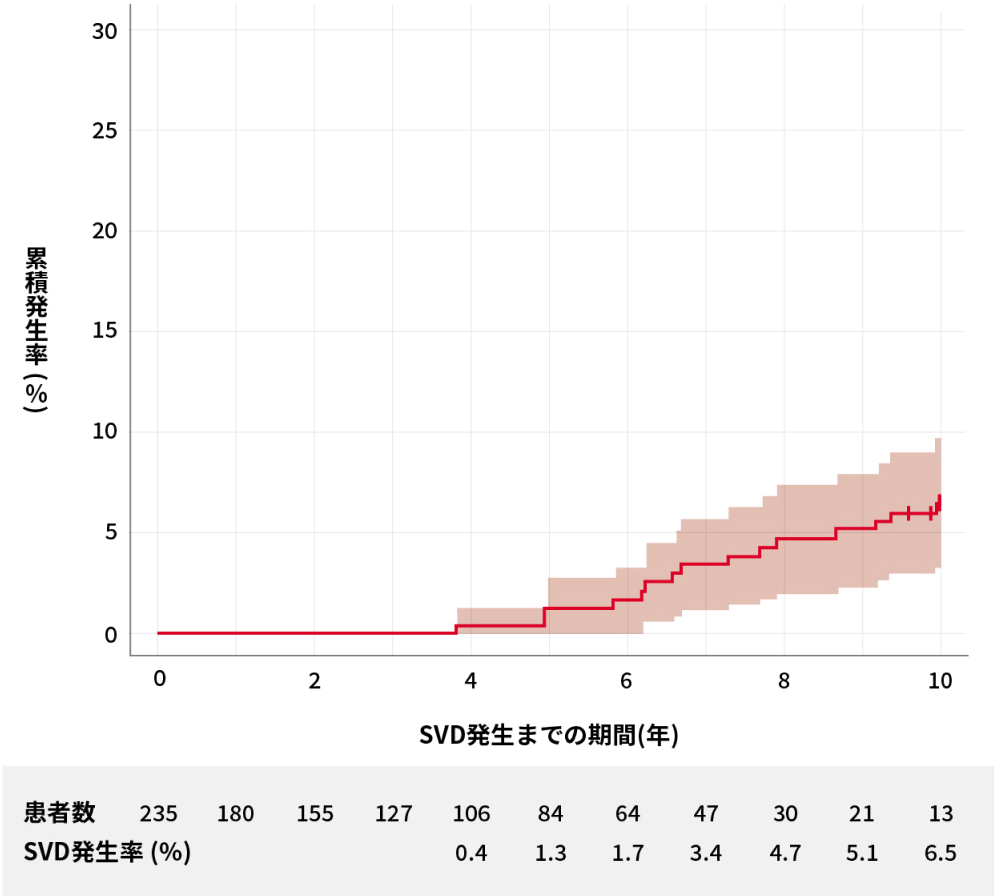
Sathananthan J, et al. Catheter Cardiovasc Interv. 2020;1–7
結論
初期世代のTAVI弁を使用したハイリスク患者の10年後のSVD/BVF発生率は低かった。本研究はTAVI弁の耐久性に関する知見を提供している。
TAVIの流れと術後
入院〜TAVI手術〜日常生活復帰までの流れ
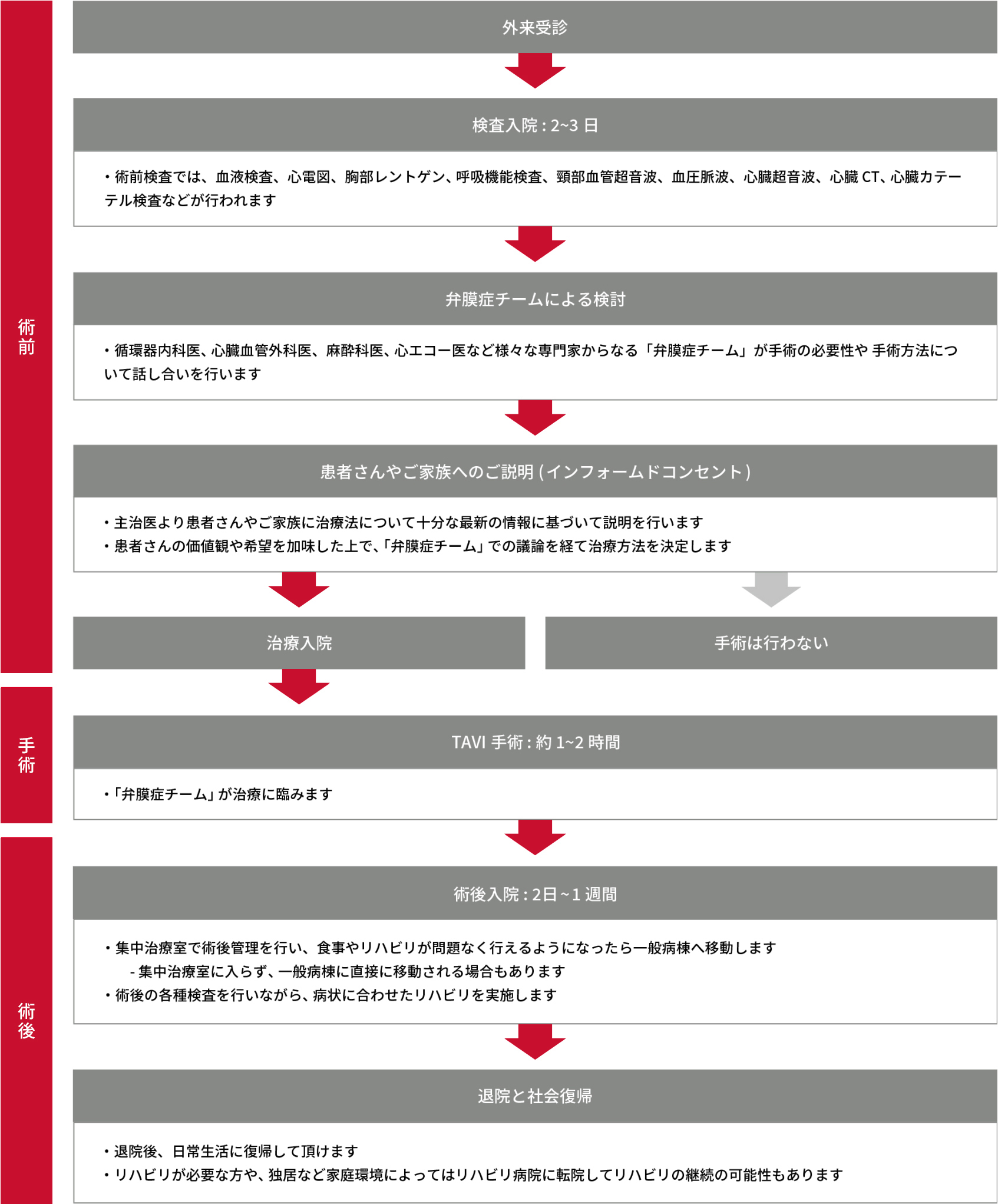
*治療の内容や手術前後の合併症の有無によって入院期間は患者さんや施設ごとに大きく異なります
TAVIを受けた後
抗血小板薬の服用
TAVIを受けた患者さんは、治療後の合併症リスク軽減のために、抗血小板薬の服用が必要な場合があります。
定期検査
手術後の定期検査は非常に重要です。生体弁の劣化などを確認するために、主に心エコー図検査(超音波検査)による定期的な観察を行ってください。
また、口の中の細菌が血流を介して人工弁に感染する可能性があるため、患者さんには半年に一度程度の歯科検診を推奨することも大切です。
患者さん自身による健康管理
体調の変化に気づくように、患者さんには毎日、体重や血圧を測定してもらい、体重が著しく増減した場合や、動悸、息切れ、むくみなど気になる症状があったら、次の定期検査を待たずに主治医に相談するように伝えてください。
References:
1. Smith CR, et al. N Engl J Med. 2011;364:2187-98., Leon MB, et al, N Engl J Med. 2016;374:1609-20., Mack MJ, et al. N Engl J Med. 2019;380:1695-1705
2. M.B.Leon et al:J Am Coll Cardiol77(9) :1149 -1161, 2021
3. Mack MJ,et al.: N Engl J Med. 2023 Oct 24. doi: 10.1056/NEJMoa2307447. Online ahead of print.
4. Yamamoto M, et al. Cardiovasc Revasc Med 2018. pii: S1553-8389 30569-4. OCEAN-TAVI registryはエドワーズライフサイエンス合同会社から資金提供を受けている
5. Blackman DJ, et al. J Am Coll Cardiol 2019;73:537-45.
6. Eltchaninoff H, et al. Euro Interv 2018;14:e264-71.
7. Sathananthan J, et al. Catheter Cardiovasc Interv. 2020;1–7